
EFEITOS DE PROBIÓTICOS NO TRATAMENTO DE DOENÇA CELÍACA: REVISÃO DE LITERATURA
Pâmela Cristina da Silva Fonseca1, Vanessa Aparecida da Silva Bernardes2, Graziele Breves dos Santos3, Bruna Barros Badaró4, Guilherme de Carvalho Yamaguchi5, Teresa C. Oliveira Marsi6
Endereço correspondente: pamela.cs.fonseca@gmail.com
Publicação: 30/12/2023
DOI: https://doi.org/10.55703/27644006030205

RESUMO
O presente artigo tem como tema central a eficácia dos probióticos quando usados para administração da doença celíaca (DC), condição autoimune desencadeada pela intolerância ao glúten. Foi explorada a relação entre os probióticos e a saúde do intestino a fim de se obter respostas sobre como os probióticos podem melhorar a microbiota intestinal, reduzir inflamações e modular o sistema imune em pacientes com a doença. Para tal, analisaram-se estudos prévios, sobretudo ensaios clínicos realizados em pacientes com DC, nas áreas da gastroenterologia, imunologia e microbiologia. Essa revisão narrativa teve foco em comparar e descrever os efeitos da utilização de probióticos quando empregados no tratamento da doença celíaca. Os estudos indicaram efeito positivo na intervenção da DC, atribuídos à capacidade dos probióticos de interagir com a microbiota intestinal. Os resultados obtidos apresentaram um panorama otimista em se tratando do papel dos probióticos para uso da mediação de portadores de DC, inclusive em crianças.
Palavras-chave: doença celíaca; DC; probióticos; microbiota intestinal.
INTRODUÇÃO
Doenças autoimunes (DAIs) são um conjunto de distúrbios ligados ao sistema imunológico (linfócitos B e T) em que o corpo ataca tecidos saudáveis e células do próprio organismo agressivamente, resultando em inflamação crônica. As mesmas acometem diretamente órgãos do corpo humano. Dados de 2022 do Ministério da Saúde demonstram que cerca de 3% a 5% da população é afetada por DAIs. Estão catalogadas cerca de 80 DAIs, como: artrite reumatoide, lúpus sistêmicos, doença de Crohn, esclerose múltipla, diabetes mellitus tipo 1, tireoidite de Hashimoto, doença celíaca (DC) entre outras (1).
Cerca de dois milhões de brasileiros são portadores de DC (2), definida como doença autoimune, caracterizada pela exposição e intolerância ao glúten. O glúten é uma proteína encontrada no trigo, aveia, cevada, centeio e seus derivados, como massas, pizzas, bolos, pães, biscoitos, cerveja, uísque, vodka e alguns doces. Portadores de DC têm achatamento das microvilosidades intestinais o que dificulta a absorção dos nutrientes dos alimentos (vitaminas, sais minerais e água) pelo organismo (1).
A literatura descreve, na prática clínica, três apresentações da doença celíaca: forma clássica, forma não clássica e assintomática ou silenciosa. O tratamento da DC é feito por meio de adaptação dietética e avaliação da exclusão de alguns nutrientes principalmente o glúten. Além disso, faz-se necessário, por meio de diagnósticos diferenciais, descartar outras doenças que possam estar atreladas ou serem confundidas com a DC, como: intolerância à lactose, síndrome do intestino irritável (SII), proliferação bacteriana e linfoma intestinal (3).
De modo geral, o tratamento das DAIs, inclusive da DC, tem como objetivo reduzir os sintomas a fim de minimizar complicações e proporcionar maior qualidade de vida ao paciente e cuidadores. Neste contexto, o tratamento incluindo uso de probióticos apresenta efeitos benéficos em diversos aspectos, como: restauração da microbiota intestinal, redução da inflamação e auxílio na regulação do sistema imune (4).
Probióticos são microrganismos vivos, compostos por bactérias benéficas a saúde, que quando ingeridos em quantidades adequadas, alteram a microbiota das mucosas intestinais equilibram e modulam a resposta imunológica. Existem inúmeras cepas de probióticos disponíveis no mercado. Alguns dos probióticos mais comuns e amplamente utilizados na DC são: Lactobacillus acidophilus, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium longum, Lactobacillus rhamnosus, Saccharomyces boulardii, Streptococcus thermophilus, Lactobacillus casei, Lactobacillus plantarum (5). A Figura 1 apresenta de forma esquemática a ação dos probióticos como coadjuvante no tratamento da DC.
Figura 1 – Processo inflamatório e rotas de ação probiótica no tratamento da DC.
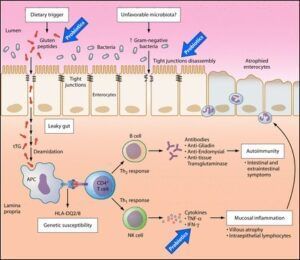
Fonte: Biologicus.
Probióticos desempenham papel coadjuvante no tratamento de DIs, inclusive DC. Na DC o sistema imunológico reage exageradamente ao glúten, resultando em danos ao intestino delgado. A ação fisiológica dos probióticos auxilia na modulação da resposta imunológica, equilibra as células do sistema imunológico, o que reduz a resposta autoimune exacerbada associada à DC, atua fortalecendo a barreira intestinal, reduzindo sua permeabilidade, o que é fundamental na DC. Ressalta-se que a permeabilidade aumentada contribui para a entrada de antígenos prejudiciais e desencadeia resposta autoimune. Além disso, alguns probióticos produzem substâncias anti-inflamatórias, como ácidos graxos de cadeia curta (AGCC). Tais substâncias auxiliam na redução da inflamação no intestino, um aspecto característico da DC, auxiliam na manutenção da microbiota intestinal saudável, inibe o crescimento de bactérias prejudiciais e favorece a diversidade microbiana. Há probióticos que auxiliam a digestão de componentes do glúten, o que reduz a carga antigênica que desencadeia a resposta imune na DC (6).
OBJETIVO
Diante de evidências sobre a eficácia terapêutica do uso de probióticos no tratamento de doenças autoimunes, o objetivo do presente estudo é revisar os efeitos dos probióticos no tratamento de indivíduos portadores de DC. Pretende-se, mais especificamente, investigar as principais cepas de probióticos utilizados no tratamento da DC, identificar os mecanismos de ação dos mesmos na redução do processo inflamatório no manejo de pacientes celíacos.
MÉTODO
Trata-se de revisão narrativa, que consiste na busca de estudos, sem esgotar as fontes de informações. Nesta, a seleção dos estudos e a interpretação de informações podem estar sujeitas à subjetividade dos autores (7).
A revisão narrativa, foi realizada no segundo semestre de 2023, e se propôs a descrever e comparar os efeitos do uso de probióticos empregados no tratamento da DC, segundo análise e interpretação de produções científicas, em língua portuguesa e inglesa, obtidas nas bases de dados: Scientific Eletronic Library Online (Scielo), Public Medline (PubMed) e Google Acadêmico, a partir dos descritores: doenças autoimunes, doença celíaca, processo inflamatório, probióticos, prebióticos.
Foram utilizados artigos de revisões sistemáticas, artigos de intervenções, teses e dissertações, trabalhos de conclusão de curso e relatos de caso, dos últimos treze anos (2010 até 2023), com exceção de artigos mais antigos que apresentaram relevância para fundamentação teórica do presente estudo.
Foram considerados como critérios de inclusão: artigos com relato de uso de bactérias probióticas e que descreviam forma de tratamento e efeitos no organismo do paciente celíaco, doenças inflamatórias intestinais e doenças autoimunes. Critérios de exclusão: artigos cuja metodologia e resultados não estavam bem apresentados e aqueles não disponíveis gratuitamente nas fontes selecionadas.
Após a seleção dos artigos, foi realizada leitura minuciosa, fichamento, tabulação, análise e discussão dos mesmos.
RESULTADOS
A avaliação dos cinco artigos de intervenção selecionados está apresentada na Tabela 1. Trata-se de ensaios duplo-cegos randomizados controlados por placebo. Dois destes, tendo como público-alvo crianças com risco ou DC e três com adultos (pacientes celíacos), divididos em dois grupos: os que foram tratados com placebo (grupo placebo = GP) e os que fizeram uso de probióticos, juntamente ou não com dieta livre de glúten (grupo tratado = GT).
Para melhor visualização dos artigos selecionados neste estudo, a Tabela 1 foi elaborada com informações sobre: autor/ano, tamanho da amostra, identificação de doses e via de administração para GP, identificação de doses e via de administração para GT, duração do tratamento e resultados obtidos.
Tabela 1 – Artigos de intervenção avaliados
| Autor /ano | Amostra (n) | GP (amostras), doses e via de administração | GT (amostras) com Probióticos, doses e via de administração
|
Duração | Resultados |
| 1
2019 |
n = 109
F (81) M (28) 18 a 63 anos |
GP = 55
Ácido láctico Aparência e sabor idênticos ao placebo, sem bactérias viáveis 1 sachê, 1 vez ao dia, via oral |
GT = 54
Mix de 5 bactérias Lactobacillus casei LMG 101/37 P-17504 (5×10⁹ UFC/sachê) Lactobacillus plantarum CECT 4528 (5×10⁹ UFC/sachê) Bifidobacterium animalis subsp. lactis Bi1 LMG P-17502 (10×10⁹ UFC/sachê), Bifidobacterium breve Bbr8 LMG P-17501 (10×10⁹ UFC/sachê), Bifidobacterium breve Bl10 LMG P-17500 (10×10⁹ UFC/sachê) 1 vez ao dia, via oral |
14 semanas, divididos em:
Run-in de 2 semanas (1ª e 2ª semana)
Tratamento de 6 semanas (3ª a 8ª semana)
Acompanhamento (9ª a 14ª semana) |
O mix de probióticos foi eficaz na melhoria da gravidade
dos sintomas do tipo SII em pacientes com DC. Maior em comparação ao GP, em ambos análise por intenção de tratar a DC (GT=14,8% vs. GP=3,6%; P<0,04) Clínicos: redução da dor, modulação da microbiota intestinal e aumento das bifidobactérias. |
| 2
2014 |
n = 33
F (18) M (15) 2 a 17 anos |
GP = 16
1 cápsula por dia, via oral com leite desnatado com 30% de sacarose e 0,5% de vitamina C com. + dieta isenta de glúten |
GT = 17
Bifidobacterium longum CECT 7347 10⁹ UFC 1 cápsula por dia, via oral + dieta isenta de glúten |
28 semanas | No GT administração de Bifidobacterium longum promoveu aumento no percentil de altura, melhora da resposta inflamatória, neutralização de desequilíbios da microbiota, redução na secreção de IgA como resposta da diminuição de patógenos nocivos, em comparação ao GP |
| 3
2019 |
n = 78
3 a 7 anos |
GP = 38
1,0 g de maltodextrina + peptona de levedura Em pó, diluído em líquido frio ou em alimentos 1 vez ao dia, via oral |
GT = 40
1,0 g de maltodextrina e bactérias liofilizadas Lactobacillus plantarum HEAL9 (DSM 15312) e Lactobacillus paracasei 8700:2 (DSM 13434), com dose total de 1010 UFC/ sachê). Em pó diluído em líquido frio ou em alimentos 1 vez ao dia, via oral |
36 semanas
Visita 1 no início do tratamento Visita 2, 3 meses após o início do estudo. Visita 3, 6 meses após o início do estudo |
3 crianças no GT e 4 crianças no GP apresentaram diarréia e flatulência;
Identificados efeitos na resposta imune periféricas em CDA, sendo que no GP os linfócitos encontrados foram semelhantes ao da DC ativa, o que não foi identificado no GT, evidenciando efeito regulatório das duas cepas de Lactobacillus em células CD4+ ativadas. Ao recrutar células T, houve melhora da resposta inflamatória |
| 4
2023 |
n = 31
F (16) M (15) 15 a 39 anos
|
GP = 16
Fruto- oligossacarídeo, lactose, estearato de Mg, e talco 3 cápsulas por dia, antes das refeições, via oral |
GT = 15
Lactobacillus casei, Lactobacillus acidophilus, Lactobacillus rhamnosus, Lactobacillus bulgaricus, Bifidobacterium breve, Bifidobacterium longum, Streptococcus thermophiles (109 UFC/cápsula para cada cepa 3 cápsulas por dia, antes das refeições, via oral |
12 semanas | Em ambos os grupos, foram relatos sintomas de distensão abdominal, fadiga, que diminuíram significativamente no GT no decorrer das semanas
As taxas de Clostridium cluster I, Bacteroidetes, Enterobacteriaceae, Lactobacillus spp., Bifidobacterium spp. e Firmicutes, exceto Staphylococcus spp. foram maiores no GT em comparação ao GP Constatado aumento de peso corporal no GT em relação ao GP |
| 5
2016 |
n = 40
1 a 19 anos |
GP =20
Excipientes sem cepas Sachê 2,0 g, em pó, misturado a líquido, 1 vez ao dia, via oral
|
GT = 20
Bifidobacterium breve BR03 (DSM 16604) e Bifidobacterium breve B632 (DSM 24706) (1:1), liofilizado Dosagem diária de 109 UFC de cada cepa Sachê 2,0g, em pó, misturado a líquido, 1 vez ao dia, via oral. |
12 semanas | O uso de probióticos (GT) induziu aumento da abundância de Firmicutes, mantendo percentagem semelhante de Bacteroidetes, resultando em valor mais elevado da relação Firmicutes/Bacteroidetes
No GC a microbiota pareceu ser caracterizada por maior percentagem de Actinobacteria e Euryarchaeota O tratamento com estirpes de B. breve não provocou grandes alterações no nível do gênero ou filo ao qual o probiótico pertence, como seria de se esperar A ingestão do probiótico atuou como um elemento “gatilho” para o aumento de Firmicutes e restauração da relação Firmicutes/ Bacteroidetes fisiológicas |
Autor/ano/país: 1) (8), 2019, Itália; 2) (9), 2014, Espanha. 3) (10), 2019, Suécia; 4) (11), 2023, Irã. 5) (12), 2016, Eslovênia. GT = grupo tratado, GP = grupo placebo, n = número de voluntários, F = feminino, M = masculino. UFC= Unidade Formadora de Colonia. SII= Sindrome do Intestino Irritável. DC = Doença Celíaca. DSG = Dieta sem glúten.
DISCUSSÃO
Após avaliação dos estudos que investigaram uso de probióticos em diferentes populações e condições de saúde (Tabela 1), foram identificados benefícios significativos em diversas áreas, como melhora dos sintomas de SII em pacientes com DC, promoção de crescimento em crianças, modulação da resposta inflamatória e alterações na composição da microbiota intestinal.
Estudo 1 (8) sobre a eficácia do uso de probióticos em SII em pacientes com DC evidenciou que o mix de cinco bactérias (2 Lactobacillus e 3 Bifidobacterium) foi eficaz na melhora dos sintomas de SII em pacientes com DC. A maior eficácia em comparação ao placebo sugere papel promissor dos probióticos na gestão de condições gastrointestinais.
Estudo 2 (9) realizado com crianças portadoras de DC, revelou que a administração de Bifidobacterium longum CECT 7347 resultou em aumento no percentil de altura e melhora na resposta inflamatória da DC.
Estudo 3 (10) realizado com crianças com DC demonstrou efeitos positivos nas respostas imunes periféricas das mesmas, apesar de alguns efeitos colaterais como diarreia e flatulência. O efeito regulatório das cepas de Lactobacillus em células CD4+ ativadas sugere potencial papel dos probióticos na modulação do sistema imunológico em condições autoimunes.
O 4º estudo (11) evidenciou redução significativa de sintomas de DC, como: distensão abdominal e fadiga com uso de mix de várias cepas de probióticos. Ressalta-se que alterações significativas na composição da microbiota intestinal corroboram com a premissa de que os probióticos podem influenciar positivamente o equilíbrio microbiano no trato gastrointestinal.
O último estudo (12) revelou que o probiótico com cepa de Bifidobacterium breve BR03 e Bifidobacterium breve B632 aumentou a abundância de Firmicutes e restaurou a relação Firmicutes/Bacteroidetes fisiológicas, que são os principais filos de bactérias que colonizam o trato gastrointestinal (TGI) e exercem papel importante na homeostase. Isso destaca o potencial dos probióticos em modular a microbiota para padrões mais saudáveis.
Os resultados positivos encontrados na avaliação dos estudos de intervenção com pacientes portadores de DC podem ser atribuídos à propriedade dos probióticos de interagir com a microbiota intestinal, promovendo ambiente propício a saúde.
É importante reconhecer limitações dos estudos avaliados, como: tamanho amostral variável, heterogeneidade nas populações estudadas, falta de padronização na dosagem e duração do tratamento, o que pode influenciar os resultados.
Para futuras pesquisas, é crucial a realização de ensaios clínicos controlados e randomizados com amostras representativas, visando aprofundar a compreensão dos mecanismos de ação específicos de cada cepa de probiótico. Além disso, investigações sobre a interação entre probióticos e microbiota em diferentes condições de saúde são necessárias para fornecer insights mais abrangentes sobre seu impacto na saúde humana.
CONCLUSÃO
A partir da revisão de literatura e análise da Tabela 1, foi possível obter visão abrangente e perspectivas promissoras quanto ao papel dos probióticos em diversas condições de saúde, especialmente no tratamento de portadores de DC, inclusive crianças.
Os resultados positivos evidenciaram melhora dos sintomas de SII, aumento do crescimento e modulação de resposta imune em crianças com DC, redução de sintomas e alterações na microbiota em pacientes com DC, além da capacidade de modular a microbiota intestinal para padrões mais saudáveis, o que reforça o potencial terapêutico dos probióticos.
Para avanços futuros, pretende-se realizar investigações mais aprofundadas sobre a interação entre probióticos e microbiota em diferentes condições de saúde. A busca por insights mais aprofundados quanto ao impacto dos probióticos na saúde humana, por meio de ensaios clínicos rigorosos, contribuirá para a consolidação do conhecimento e desenvolvimento de estratégias terapêuticas personalizadas e eficazes, de forma a promover abordagem mais precisa e eficiente no manejo de condições gastrointestinais e imunológicas.
REFERÊNCIAS
- Ministério da Saúde. Doença celíaca. Biblioteca Virtual em Saúde MS [internet]. [s.d.][citado 11 out. 2023]. Disponível em: https://bvsms.saude.gov.br/doenca-celiaca/#:~:text=Doen%C3%A7a%20cel%C3%ADaca%20%C3%A9%20uma%20doen%C3%A7a.
- Conselho Nacional de Saúde. FENACELBRA lança campanha “RECONHECER” no mês de maio em comemoração ao Dia Internacional dos Celíacos. Conselho Nacional de Saúde [Internet]; 2013[citado 8 dez. 2023]. Disponível em: https://conselho.saude.gov.br/ultimas_noticias/2013/05_maio_14_fenacelbra.html#:~:text=A%20doença%20celíaca%20pode%20aparece
- Eloi da Luz CRNE, Leandro, Mouzinho LS, Reis ERSN, Albuquerque IL, Sales SPMA, Costa BJS. Manifestações clínicas, laboratoriais e histologicas da doença celíaca: relato de caso. Rev Pato Tocantins. 2020;7(1):28.
- Vandenplas Y; Veereman-Wauters G, De Greef E, Peeters S, Casteels A, Mahler T, Devreker T, Hauser B. Probiotics and prebiotics in prevention and treatment of diseases in infants and children. J Pediatr (Rio J). 2011;87(4):292-300.
- Saad SMI. Probióticos e prebióticos: o estado da arte. Rev Bras Ciênc Farmac. 2006;24(1):1-16.
- Losurdo G, Principi M, Iannone A, Ierardi E, Di Leo A. The interaction between celiac disease and intestinal microbiota. J Clin Gastroenterol. 2016;50:145-7.
- Tipos de revisão de literatura. São Paulo: Faculdade de Ciências Agronômicas UNESP, Botucatu, 2015[citado 11 out. 2023]. Disponível em: https://www.fca.unesp.br/Home/Biblioteca/tipos-de-evisao-de-literatura.pdf
- Francavilla R, Piccolo M, Francavilla A, Polimeno L, Semeraro F, Cristofori F, Castellaneta S, Barone M, Indrio F, Gobbetti M, De Angelis M. Clinical and Microbiological Effect of a Multispecies Probiotic Supplementation in Celiac Patients With Persistent IBS-type Symptoms A Randomized, Double-Blind, Placebo-controlled, Multicenter Trial. J Clin Gastroenterol. 2019; 53(3):117–125.
- Olivares M, Castillejo G, Varea V, Sanz Y. Double-blind, randomised, placebo-controlled intervention trial to evaluate the effects of Bifidobacterium longum CECT 7347 in children with newly diagnosed coeliac disease. British Journal of Nutrition. Cambridge University Press; 2014;112(1):30–40.
- Håkansson Å, Andrén Aronsson C, Brundin C, Oscarsson E, Molin G, Agardh D. Effects of Lactobacillus plantarum and Lactobacillus paracasei on the Peripheral Immune Response in Children with Celiac Disease Autoimmunity: A Randomized, Double-Blind, Placebo-Controlled Clinical Trial. Nutrients 2019;11(8):1925. https://doi.org/10.3390/nu11081925.
- Soheilian Khorzoghi M, Rostami-Nejad M, Yadegar A, Dabiri H, Hadadi A, Rodrigo L. Impact of probiotics on gut microbiota composition and clinical symptoms of coeliac disease patients following gluten-free diet. Contemporary Clinical Trials Communications 2023;35:101201. https://doi.org/10.1016/j.conctc.2023.101201.
- Quagliariello A, Aloisio I, Bozzi Cionci N, Luiselli D, D’Auria G, Martinez-Priego L, Pérez-Villarroya D, Langerholc, Pintarič M, Mičetić-Turk D, Di Gioia D. Effect of Bifidobacterium breve on the Intestinal Microbiota of Coeliac Children on a Gluten Free Diet: A Pilot Study. 2016;8(10):660.
- Rodrigues RA, Dias IP, Lago M de L, Nunes RF. Probióticos e suas aplicações clínicas: uma abordagem multidisciplinar. RSM [internet]. 23º de fevereiro de 2021 [citado 26 out. 2023];7(1). Disponível em: http://revistas.famp.edu.br/revistasaudemultidisciplinar/article/view/222.
- Rostom A, Murray JA, Kagnoff MF. American Gastroenterological Association (AGA) Institute Technical Review on the Diagnosis and Management of Celiac Disease. Gastroenterology 2006 [citado 26 out. 2023];131:1981–2002. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S001650850602227X
- Silva TS da G e, Furlanetto TW. Diagnóstico de doença celíaca em adultos. Rev Assoc Med Bras 2010 [citado 26 out. 2023];56:122–6. Disponível em: https://doi.org/10.1590/s0104-42302010000100027.
- [Doença celíaca e probióticos] Biologicus [internet]; [citado 8 dez 2023]. Disponível em: https://biologicus.com.br/2019/05/29/doenca-celiaca-e-probioticos/.
- Golfetto L, Senna FD de, Hermes J, Beserra BTS, França F da S, Martinello F. Lower bifidobacteria counts in adult patients with celiac disease on a gluten-free diet. Arq Gastroenterol 2014 [citado 26 out. 2023];51:139–43. Disponível em: https://doi.org/10.1590/s0004-28032014000200013.
- Magalhães L de O. Modulação probiótica no tratamento da doença celíaca. Repositorio UNIFESP [Internet]. 7 jul. 2023 [citado 26 out. 2023]; Disponível em: https://repositorio.unifesp.br/handle/11600/68654 Magalhães Lde O.
