
REVISTA CIENTÍFICA IPEDSS: A CIÊNCIA A FAVOR DA SAÚDE E SOCIEDADE
ISSN 2764-4006
DOI 1055703
Volume 2. Número 2.
Petrolina, 2022.
RELATO DE CASO SOBRE EVOLUÇÃO ATÍPICA APÓS HEMORRAGIA SUBARACNÓIDEA
Lucas Luiz Fitipaldi Ferreira¹, Lizandra Couto Raymundo², Ana Paula da Silva³, Elizangela dos Anjos Silva 4 e Heber Amilcar Martins5
Endereço correspondente: Lucas Luiz Fitipaldi Ferreira – Cândido Mota, SP – Brazil – E-mail: lucasfitipaldi@hotmail.com
Submissão: 18 de Abril, 2022 – Modificação: 25 de Abril, 2022 – Aceito: 20 de Junho, 2022
DOI: https://doi.org/10.55703/27644006020201
RESUMO
A hemorragia subaracnóidea é uma das formas clínicas do acidente vascular cerebral hemorrágico, caracterizada pela presença de sangue no espaço subaracnóideo. Relatamos o caso de uma evolução e recuperação atípicas após hemorragia subaracnóidea admissional resultante de rotura de aneurisma em artéria comunicante posterior esquerda associada com pneumonia broncoaspirativa bilateral. Três dias após a neurocirurgia, a paciente recebeu alta sem sequelas cognitivas, motoras ou sensitivas, mesmo na presença de inúmeros fatores limitantes ao prognóstico durante evolução clínica-cirúrgica.
Palavras-chave: Acidente vascular cerebral; enxaqueca com aura; hemorragia subaracnóidea; aneurisma; prognóstico.
INTRODUÇÃO
A hemorragia subaracnóidea (HSA) é uma das formas de expressão clínica do acidente vascular cerebral (AVC), caracterizada pelo extravasamento de sangue para o espaço subaracnóideo, cuja etiologia pode ser resultante da ruptura aneurismática. Nesse contexto, a HSA está associada a uma taxa de mortalidade de 40-60%. Aproximadamente 15% dos pacientes com HSA evoluem para o óbito antes de chegar ao hospital, 25% morrem dentro das primeiras 24 horas e 45% dos pacientes falecem dentro de 30 dias. As taxas de mortalidade em regime de internação hospitalar variam entre 33% a 45%. A HSA representa uma situação clínica desafiadora, com uma incidência que varia de acordo com o país estudado, como por exemplo, na China há dois casos a cada 100.000 habitantes, enquanto na Finlândia são 22,5 casos para o mesmo total de indivíduos.
A faixa etária frequentemente acometida está entre os 40 e 60 anos de idade, mas pode afetar desde crianças a idosos. Diante desse espectro, o manejo dessa condição é tão complicado quanto controverso e está diretamente relacionado ao fator desencadeante subjacente, incluindo hemorragia intracerebral, hidrocefalia, hemorragia intraventricular e vasoespasmo, com ou sem infartos corticais e subcorticais cerebrais (1-2, 8,18-19).
Em 1985 um subtipo de HSA perimesencefálica não aneurismática foi descrita, a qual é caracterizada por certa distribuição de sangue no espaço subaracnóideo perceptível pela tomografia computadorizada (TC) de crânio, com angiografia normal e um curso clínico favorável que as distinguiu das demais HSAs aneurismáticas e outras de etiologia desconhecida. Mediante esse contexto apresenta-se com bom prognóstico, sendo a recuperação, na maioria dos casos, completa e satisfatória. A incidência da HSA perimesencefálica varia entre 8 e 11% de todas as HSAs espontâneas. Quanto à origem, há consenso de que se trate de um sangramento de baixa pressão intravascular que produz um foco hemorrágico limitado, portanto, com menores taxas de complicações à qualidade de vida do paciente (3-5).
Dentre as manifestações clínicas da HSA, a cefaleia é o sintoma mais relatado. Esta é caracterizada por início abrupto, de caráter em trovoada, com intensidade máxima dentro de um minuto. Entretanto, outros fatores também contribuem para desenvolver um baixo limiar de suspeita clínica de dor de cabeça secundária a HSA, por exemplo, quando os pacientes apresentam sintoma com evolução aguda, diferença na gravidade ou qualidade em comparação com cefaleias anteriores e a verificação de outros sintomas, particularmente rigidez de nuca, mas também convulsão, síncope, déficit neurológico focal e vômitos (8).
Os principais fatores de risco relacionados ao pior prognóstico da HSA incluem a hipertensão arterial sistêmica e o tabagismo. Além disso, estudos comprovam que fatores como idade acima de 65 anos, sexo feminino, hipertensão arterial sistólica, hiperglicemia na admissão hospitalar, complicações como sepse respiratória, distúrbios hidroeletrolíticos, hidrocefalia, ressangramento único ou múltiplo, vasoespasmo sintomático, infarto cerebral, bem como os graus III e IV das escalas da Federação Mundial de Neurocirurgiões (WFNS-1988) e Fisher (1980), limitam o prognóstico e contribuem para um desfecho clínico desfavorável (6-7).
Entre os pacientes com história pregressa de um evento de AVC, os sintomas depressivos e o fatalismo, mas não o otimismo ou a espiritualidade, estão associados ao aumento do risco de recorrência e da taxa de mortalidade. Fatores de risco não convencionais podem explicar parte da variabilidade nos desfechos de AVCs observados em populações e podem ser novos alvos de intervenção (9). Estudos demonstram que a recuperação do paciente após AVC é um processo complexo, envolvendo muitas vezes esforços significativos (10).
Apresentação do Caso Clínico
O caso clínico é de uma paciente (sexo feminino), 45 anos de idade, com crises migranosas há duas décadas. Ela apresentou cefaleia em trovoada e rigidez de nuca, ambos incapacitantes com regressão parcial à analgesia.
Quatro dias após o primeiro evento, a paciente evoluiu de forma súbita com uma crise convulsiva, caracterizada por hemiplegia e hemiparesia à direita concomitantemente com a evocação de death ratlle. A TC realizada na admissão hospitalar evidenciou HSA e HSA perimesencefálica por provável ruptura aneurismática. No exame físico ela apresentou mau estado geral, hipotensão arterial sistêmica, bradipneia, escala de Ramsay (1974) com seis pontos, oligúria e estertores pulmonares crepitantes bilateralmente. O estudo radiológico de tórax demonstrou a presença de pneumonia broncoaspirativa bilateral. O risco de ressangramento era elevado segundo a apresentação sintomatológica inicial.
Durante a internação na unidade de terapia intensiva (UTI), a paciente apresentou infecção do trato urinário por Escherichia coli, resolvida subsequentemente com antibioticoterapia sistêmica, febrícula acompanhada de edema em membros inferiores, incremento de pressão de dióxido de carbono e oxigênio, hipopotassemia, hiponatremia e hipermagnesemia além de hipocromia, trombocitopenia e leucocitose com neutrofilia. Manteve hipóxia (SaO2 76%), leucocitose com presença de granulações tóxicas e desvio a esquerda, anisocitose, eritroponia, uricemia, hiperglicemia, hipercalcemia e hipercalemia e insuficiência renal aguda. Posteriormente apresentou febre moderada. Nove dias após a admissão hospitalar, a TC revelou ausência de sangue no espaço subaracnóideo e perimesencefálico.
O retorno da motricidade e sensibilidade do antímero direito foram observados no décimo primeiro dia, com evolução gradativa à redução de sedação. No mesmo período os picos febris tornaram-se esparsos, porém presentes. No décimo quarto dia evoluiu com discinesia.
A angiografia evidenciou rotura aneurismática na artéria comunicante posterior (ACoP) esquerda, e a paciente foi submetida a neurocirurgia para clipagem vascular. No período pós-cirúrgico, foi constatada infecção hospitalar por Klebsiella pneumoniae carbapenemase multirresistente a antibioticoterapia. Três dias após a intervenção neurocirúrgica, ela recebeu alta hospitalar sem a presença de sequela motora ou sensitiva. Com esse contexto, destaca-se a espiritualidade como fator prevalente durante todo o período de reabilitação e recuperação, tanto da perspectiva da paciente como do seu filho mais velho, com a intenção de alcançar o patamar do potencial de cura.
DISCUSSÃO
A cefaleia despontou como o principal motivo para a busca de atendimento médico pela utente. Esse sintoma é extremamente comum na prática clínica e a análise das características da apresentação foram determinantes para o desfecho do diagnóstico. A descrição da cefaleia refratária à analgesia e diferente das anteriores, bem como a dor na flexão cervical, foram os sinais de alerta para a suspeição de uma afecção orgânica grave que merecia avaliação imediata.
O quadro clínico da HSA é exemplificado por cefaleia intensa e súbita, descrita frequentemente pelos pacientes como “a pior da vida”, que pode ser acompanhada de outros sintomas gastrointestinais, como náuseas e vômitos, além de fotofobia e rigidez nucal. Ao exame físico os principais achados são: elevação leve a moderada da pressão arterial sistêmica, taquicardia, papiledema, sinais meníngeos e déficits neurológicos focais, principalmente, a paralisia dos músculos oculomotores. Todavia, não são raras vezes em que as manifestações clínicas são inespecíficas, como cefaleia autolimitada e tonturas resultantes do efeito de massa do aneurisma, que sinalizam a hemorragia sentinela, apresentada pela paciente no primeiro episódio (15-16). Atualmente acredita-se que a HSA configura em uma doença crônica com risco de desenvolvimento de novos aneurismas e consequente rotura. Os fatores de risco são semelhantes às doenças cardiovasculares, sendo que mais de 40% dos sobreviventes do evento hemorrágico inicial falecem por infarto agudo do miocárdio ou pela eclosão de um novo AVC (17).
Perante a avaliação do caso clínico descrito, a paciente era isenta dos principais fatores de risco para a HSA, apresentando apenas a enxaqueca como marcador da história mórbida pregressa, entretanto, essa condição pode ter contribuído com a ruptura aneurismática.
Nas análises estratificadas por tipo e gênero de enxaqueca, a associação de mulheres enxaquecosas com aura com um maior risco à deflagração de HSA ainda permanece controversa na literatura.
Sacco et al. (2013) em uma metanálise, não observaram inter-relações de susceptibilidade entre a hemorragia intraparenquimatosa e subaracnóidea em pacientes que apresentam migrânea.
Contudo, o risco de AVC hemorrágico foi relatado como maior em mulheres com quaisquer formas de enxaqueca e em mulheres com idade inferior a 45 anos (13). Os mecanismos patogênicos subjacentes na interconexão da enxaqueca com doença vascular cerebral não estão bem compreendidos. A possível explicação pode depender de uma vulnerabilidade vascular peculiar da migrânea e na presença de outros fatores desconhecidos, contribuindo ao longo do tempo para o desenvolvimento de eventos cerebrovasculares (13).
A HSA está frequentemente associada a complicações sistêmicas como edema pulmonar, hiponatremia, hipercalemia e trombose venosa profunda; fatores esses limitantes ao prognóstico (18-19). A paciente apresentou ao longo da evolução clínica a deflagração de fatores que contribuíram diretamente para a perda da reserva funcional e cognitiva, no entanto, todos tiveram resolubilidade com a consonância entre o adequado manejo clínico-cirúrgico com a espiritualidade da paciente.
Desde a admissão hospitalar, os entes mais próximos da paciente, especialmente os filhos, demonstram esperança no potencial de cura da mãe com o tratamento. Um dos eventos que podem caracterizar tal provável influência seria a ausência de sangue no espaço subaracnóideo em menos de dez dias, sem nenhuma intervenção cirúrgica. Embora haja certa divergência perante a literatura, alguns autores apontam um papel positivo da espiritualidade em doenças coronarianas, hipertensão arterial sistêmica, transtornos ansiosos, transtornos depressivos, função imune e mortalidade em geral.
Existem evidências de que pessoas com algum tipo de espiritualidade apresentam menor incidência dessas doenças e vivem mais, recuperam-se mais rapidamente quando doentes e apresentam menos complicações durante o tratamento. Esses possíveis benefícios da espiritualidade sobre a saúde podem estar associados desde as reações fisiológicas mais simples, como a redução da tensão muscular, o efeito inotrópico negativo e queda dos níveis pressóricos sanguíneos, como também a reações mais complexas, como maior capacidade para a modulação da dor e sofrimento bem como da diminuição das reações ao estresse, levando a um maior homeostase das respostas imunologicamente moduladas. Os efeitos da espiritualidade sobre a saúde podem envolver mecanismos biológicos úteis, além dos conhecimentos científicos atuais, que, com o tempo, podem vir a ser entendidos e elucidados (9,20).
Figura 1 – Tomografia computadorizada de crânio evidenciou extensa hemorragia subaracnóidea, com acúmulo de sangue principalmente em hemisfério esquerdo e em mesencéfalo (A-C). A tomografia computadorizada de crânio revelou ausência de sangramento sem intervenção neurocirúrgica.
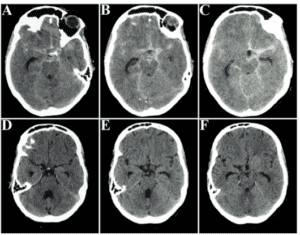
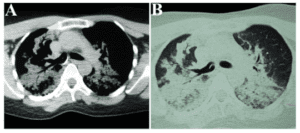
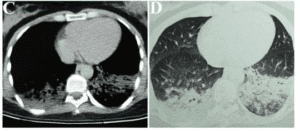
Figura 2 – Tomografia computadorizada de tórax evidenciou pneumonia broncoaspirativa bilateral, principalmente, em bases pulmonares.
CONSIDERAÇÕES FINAIS
O diagnóstico rápido e uma conduta apropriada são decisivos para assegurar a sobrevida e minimização de sequelas. A escolha da terapêutica a ser adotada suscita discussões devido à individualidade da condição clínica, idade, características do aneurisma e relações com os vasos regionais, por isso da necessidade da abordagem profissional integrada bem como de outras variáveis para a determinação de desfecho favorável, não totalmente elucidados mediante à ótica científica, como a espiritualidade.
REFERÊNCIAS
1. Sahu B, Kranthi S, Aniruddh P. Factors affecting outcome in poor grade subarachnoid haemorrhage: An institutional study. Asian Journal of Neurosurgery. 2016;11(4):365.
2. Ingall T, Asplund K, Mahonen M, Bonita R. A Multinational Comparison of Subarachnoid Hemorrhage Epidemiology in the WHO MONICA Stroke Study. Stroke. 2000;31(5):1054-1061.
3. Schwartz TH, Solomon RA. Perimesencephalic nonaneurysmal subarachnoid hemorrhage: review of the literature. Neurosurgery. 1996; (39): 433-440.
4. Van Gijn J, Van Dongen KJ, Vermeulen M, Hijdra A. Perimesencephalic hemorrhage: a nonaneurysmal and benign form of subarachnoid hemorrhage. Neurology. 1985; (35): 493-497
5. Flaherty ML, Haverbush M, Kissela B, Kleindorfer D, Schneider A, Sekar P, et al. Perimesencephalic subarachnoid hemorrhage: incidence, risk factors, and outcome. J Stroke Cerebrovascular Disease. 2005; (14): 267-271.
6. Rivero Rodríguez D, Scherle Matamoros C, Fernández Cúe L, Miranda Hernández J, Pernas Sánchez Y, Pérez Nellar J. Factores asociados a una evolución desfavorable en la hemorragia subaracnoidea aneurismática. Serie de 334 pacientes. Neurología. 2017;32(1):15-21.
7. Bellolio M, Hess E, Gilani W, VanDyck T, Ostby S, Schwarz J et al. External validation of the Ottawa subarachnoid hemorrhage clinical decision rule in patients with acute headache. The American Journal of Emergency Medicine. 2015; 33(2): 244-249.
8. Morgenstern L, Sánchez B, Skolarus L, Garcia N, Risser J, Wing J et al. Fatalism, Optimism, Spirituality, Depressive Symptoms, and Stroke Outcome. Stroke. 2011;42(12):3518-3523.
9. Robinson-Smith G. Prayer after Stroke. Journal of Holistic Nursing. 2002;20(4):352-366
10. Lipton RB, Bigal ME, Diamond M, Freitag F, Reed ML, Stewart WF, AMPP Advisory Group (2007) Migraine prevalence, disease burden, and the need for preventive therapy. Neurology (68): 343–349
11. Sacco S, Kurth T. Migraine and the Risk for Stroke and Cardiovascular Disease. Current Cardiology Reports. 2014;16(9).
12. Sacco S, Ornello R, Ripa P, Pistoia F, Carolei A. Migraine and Hemorrhagic Stroke: A Meta-analysis. Stroke. 2013;44(11):3032-3038.
13. Singer RJ, Ogilvy CS, Rordorf G. Etiology, clinical manifestations, and diagnosis of aneurysmal subarachnoid hemorrhage. UpToDate [Internet]; 2010 [cited 2015 Mar 10]. Available from: lINK
14. Kowalski RG, Claassen J, Kreiter KT, Bates JE, Ostapkovich ND, Connolly ES, et al. Initial misdiagnosis and outcome after subarachnoid hemorrhage. JAMA. 2004;291(7):866-9
15. Why patients with a SAH need multidisciplinary follow-up. Lancet Neurol. 2011;10(4):289
16. Bederson JB, Connolly ES Jr, Batjer HH, Dacey RG, Dion JE, Diringer MN, Duldner JE Jr, Harbaugh RE, Patel AB, Rosenwasser RH; American Heart Association. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 2009;40(3):994-1025. Erratum in: Stroke. 2009;40(7):e518.
17. Kothavale A, Banki NM, Kopelnik A, Yarlagadda S, Lawton MY, Ko N, et al. Predictors of left ventricular regional wall motion abnormalities after subarachnoid hemorrhage. Neurocrit Care. 2006;4(3):199-205.
18. Schievink WI. Intracranial aneurysms. N Engl J Med. 1997;336(1):28-40. Review. Erratum in: N Engl J Med. Schievink WI. Intracranial aneurysms. N Engl J Med. 1997;336(1):28-40.
19. Suarez JI, Tarr RW, Selman WR. Aneurysmal subarachnoid hemorrhage. N Engl J Med. 2006;354(4):387-96.
20. Weathers, E., McCarthy, G., & Coffey, A. (2015). Concept Analysis of Spirituality: An Evolutionary Approach. Nursing Forum, 51(2), 79–96. doi:10.1111/nuf.12128
Download do PDF:
RELATO DE CASO SOBRE EVOLUÇÃO ATÍPICA APÓS HEMORRAGIA SUBARACNÓIDEA